丁梅研究组与何康敏研究组合作揭示内体成熟调控新机制
发布时间:2024.11.26
内体成熟(Endosome maturation)是细胞内对内吞物质进行分选、运输和降解的重要过程。细胞外物质或细胞膜组分通过内吞作用进入细胞后,首先被转运至早期内体(Early Endosomes, EEs)。在内吞分选转运复合体(ESCRTs)的帮助下,早期内体中的货物被包裹形成管腔内囊泡(Intraluminal Vesicles, ILVs),将货物分选至多囊泡体(Multivesicular Bodies, MVBs)/晚期内体(Late Endosomes, LEs),最终与溶酶体融合,完成对货物的降解。这一过程在维持细胞稳态、营养供给和自我防御等方面具有重要意义。
内体成熟的关键标志之一是小G蛋白Rab5向Rab7的转换。然而,目前对这一转换过程在时间和空间上如何受到精确调控仍有待研究。利用线虫进行遗传学筛选,我们发现编码去泛素化酶的基因usp-50发生突变时,导致内体成熟受阻。具体表现为早期内体异常增大,而晚期内体及溶酶体的形成受到抑制。在哺乳动物细胞中敲除usp-50的同源基因USP8,同样观察到类似的内体成熟缺陷。进一步研究表明,USP8通过与Rab5的鸟嘌呤核苷酸交换因子(GEF)Rabex5直接结合,被招募至Rab5标记的早期内体。USP8通过对Rabex5中具有GEF活性的Vps9结构域进行去泛素化作用,促使Rabex5从早期内体解离,同时促进了Rab7 GEF SAND-1/Mon1的招募。这一机制确保了Rab5向Rab7的有效转换,并推动内体的正常成熟。
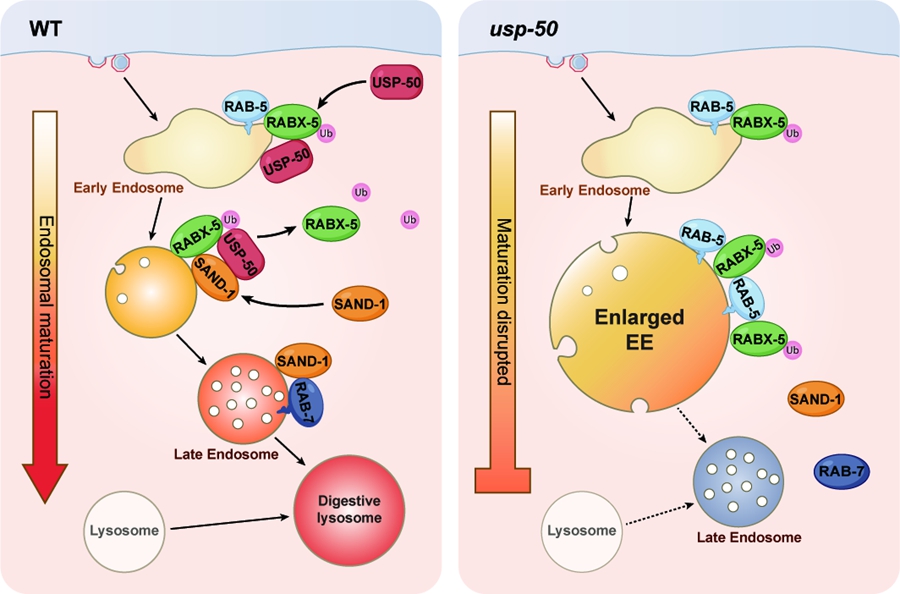
图:USP8/USP-50调控内体成熟过程
去泛素化酶USP8被认为是库欣综合征及多种肿瘤的重要治疗靶点,本研究揭示了USP8在调控内体成熟中的新功能,为进一步探索USP8相关疾病的治疗策略提供了新的思路。该项研究成果于2024年11月22日正式发表于eLife (DOI:10.7554/eLife.96353)杂志。中国科学院遗传与发育生物学研究所博士后缪悦和杜勇涛为本文的共同第一作者。该项研究由何康敏与丁梅研究组合作完成,并得到中国科学院生物物理所李栋研究组大力协助。经费资助来源于国家自然科学基金委和国家重点研发计划。