分子伴侣折叠体内10-20%的蛋白质,并参与蛋白质运输,组装复杂蛋白复合体,在生命体的正常生长与逆境胁迫过程中起关键作用。分子伴侣素(Chaperonin),也即分子伴侣Hsp60,是一类广泛分布在原核生物和真核生物中的重要伴侣蛋白,是分子量为60 kD 的亚基组装的双环桶状寡聚体(含14~18个亚基),底物蛋白在中央空腔内进行折叠。目前,真细菌分子伴侣素GroEL、线粒体分子伴侣素Hsp60、真核生物胞质分子伴侣素TRiC、古细菌分子伴侣素热聚体都有电镜和晶体结构报道,对它们的功能循环机制也有深入的研究。叶绿体chaperonin(Cpn60)亚基分化成两大类型:α 和 β,折叠光合作用固碳关键酶Rubisco大亚基,在Rubisco生物合成途径中具有关键作用。但Cpn60的结构和功能协作模式并不清楚。
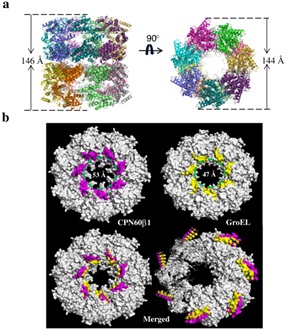
中国科学院遗传与发育生物学研究所刘翠敏研究组,联合上海同步辐射光源(大科学装置)成功解析了第一颗真核生物(衣藻,Chlamydomonas reinhardtii)叶绿体Cpn60β1的同源寡聚体结构(分子量高达800 kD),分辨率达3.8 ?:与GroEL相比,Cpn60的底物结合空腔直径变大,亚基排列疏松,还拥有更宽的ATP结合口袋等显著特点,这些发现完美解释了Cpn60聚合体状态不稳定,高ATP酶活,和易被蛋白酶降解等前期研究发现的Cpn60代表性现象,为Cpn60的研究奠定了结构认知基础。同时,在体外证明了Cpn60β1可以和众多辅伴侣互作,具有ATP酶活性和正确的分子变构形式(电镜观察到‘football和bullet’两类经典形式),且可以回补GroEL缺失造成的致死表型。进一步通过结构域交换重组和定点突变,揭示决定不同类型亚基明显生化性质差异的分子基础:赤道区决定聚合体的形成并参与不同类型亚基间的分子协作,对功能发挥起重要作用。这些结果一方面填补了Cpn60研究的结构空白,另一方面首次报道了Cpn60α赤道区导致的单体倾向对异源寡聚体功能发挥的重要贡献。
该研究成果2016年4月12日在线发表于BMC Biology上(DOI 10.1186/s12915-016-0251-8),刘翠敏研究组博士研究生张世佳为该论文第一作者。此研究得到了植物细胞与染色体工程国家重点实验室和国家自然科学基金的资助。
图1. 衣藻叶绿体Cpn60β1的同源寡聚体晶体结构