大脑将大部分能量用于维持膜脂动力学,以保证包括磷脂和鞘磷脂在内的各种膜脂的脂肪酰基组成的特异性。因此,不同膜脂的脂肪酰基严格的异质性对于维护膜脂完整和大脑的正常运作极其重要。恒河猴,由于与人类基因的高度同源性(约92.5%至95%),在年龄相关表型上会表现出高度类似的正常衰老状态。尽管已有大量研究工作致力于揭示多不饱和脂肪酸(PUFAs)在神经病学上对于人脑衰老的影响;并且,若干临床研究也清楚阐述了在人类正常衰老过程的二十二碳六烯酸(DHAs)稳态的动态变化。但在动物或体外研究中没有观察到相似的变化。缺乏合适的动物模型以及人脑组织研究的伦理约束在很大程度上限制了PUFA与大脑的研究。
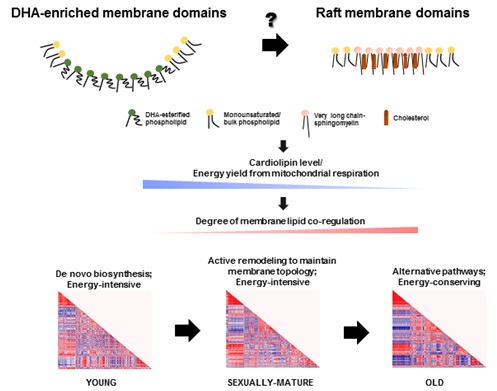
中国科学院遗传与发育生物学研究所税光厚研究组运用前沿脂组学技术,报道了三个不同年龄阶段(幼年、成年和老年)恒河猴的前额叶组织中膜脂变化具体到各种脂肪酰的脂纹谱。通过对恒河猴的前额叶膜脂脂肪酰基专项分析有力地证明恒河猴是一个合适作为研究人类大脑正常衰老的模型,尤其是在多不饱和脂肪酸代谢方面。值得注意的是,脂组学分析显示磷脂中PUFA随年龄的分布变化;而二十二碳六烯酸(DHAs)在成年恒河猴所有检测出的脂类中都呈现显著地增加,而该种增加仅限于DHA其他多饱和脂肪酸(PUFAs)却无此现象。另一方面,花生四烯酸(ARA)在成年恒河猴膜脂中急剧减少,其中只有心磷脂(CL)该种变化有所减弱。有趣的是,在老年恒河猴中富含DHA的磷脂减少而超长链鞘磷脂(VLC-SMs)却增加,相关性分析证实随着年龄的增长膜脂的关联调控程度会不断加深。尤其是老年恒河猴,心磷脂与富含PUFA的磷脂呈现正相关调控,而富含DHA的磷脂与超长链鞘磷脂呈现负相关调控。因此,脂组学数据揭示一种值得注意的可能性:在神经膜上富含DHA的膜微区和富含鞘磷脂/胆固醇的膜筏可能存在着复杂的时间相互作用。
脂质关联调控分析也表明随年龄功能膜微区转换(由富含DHA的膜微区转变为富含鞘磷脂/胆固醇脂筏)会改变CL重构的效率,从而导致心磷脂含量逐渐减少,通过线粒体氧化磷酸化的能量供应减少。随着能量供给减少和膜拓扑结构的改变会启动替代的磷脂合成通路,取代维持膜动态的从头合成通路以减少能量消耗,这也可以解释在老年恒河猴中独特的膜脂关联调控。根据这一理论,引发大脑衰老的关键节点本质上也许是无法维持神经膜脂中DHA的高水平。此外,在老年恒河猴中LPC-22:6和LPE-22:6与含有DHA磷脂之间无关联调控暗示造成富含DHA磷脂的减少的主要原因是无法将含有DHA的溶血磷脂转换为对应膜脂,而不是无法提供能跨过血脑屏障富含DHA的溶血磷脂。值得注意的是,这个机制推测与临床观察相符合:DHA饮食补充可有效阻止或延缓神经退行性疾病发病却对确诊的阿尔茨海默症的治疗没有效果。这说明神经膜脂中DHA显著下降危害也许远胜于食物中DHA供给本身的减少。
相关研究结果于2016年8月10日在线发表于Oncotarget杂志(DOI: 10.18632/oncotarget.11190)。税光厚研究组Sin Man Lam博士后为该论文的第一作者,税光厚研究员为该论文的通讯作者。该项目得到了国家自然科学基金委员会项目、中国博士后特别基金项目的资助。