杨崇林研究组和郝小江研究组联合揭示溶酶体生成的调控机制
发布时间:2016.09.13
Nature Cell Biology 2016年9月12日前以长文(Article)形式在线发表中国科学院遗传与发育生物学研究所杨崇林研究组与中国科学院昆明植物学研究所郝小江研究组的合作研究论文“PKC controls lysosome biogenesis independently of mTORC1” (http://www.nature.com/ncb/journal/vaop/ncurrent/full/ncb3407.html)。该论文揭示了细胞内溶酶体生成的重要信号传导和调控机制。
溶酶体是细胞内物质降解和信号转导的重要中心之一。溶酶体降解来源于细胞内、外的各种底物,如内吞膜蛋白及小分子物质、凋亡细胞、病原菌和自噬小体等。溶酶体的功能紊乱直接导致70多种溶酶体贮积病,且与神经退行性疾病密切相关。控制细胞代谢的关键激酶mTOR定位于溶酶体上,通过感知细胞的营养状态来调节细胞的生长和代谢。已有研究发现,mTOR可以磷酸化溶酶体生成的转录因子TFEB和TFE3,抑制细胞内的溶酶体生成。当细胞处于饥饿状态时,mTOR不能磷酸化TFEB/TFE3。未磷酸化的TFEB/TFE3因而进入细胞核中启动溶酶体生成相关基因的转录,促进溶酶体的发生。但是,在正常营养供给状态下,细胞如何应对于内、外界信号而促进溶酶体的生成,是一个悬而未决的重要问题。
杨崇林研究组与郝小江研究组合作,以活性天然小分子为探针,从化学生物学的角度探索溶酶体发生和稳态平衡的调控机制。该研究首先建立溶酶体生成的筛选体系,经过大量筛选,从植物天然产物中发现了能在细胞正常营养状态下促进溶酶体生成的、以HEP14和HEP15为代表的一类巨大戟烷型二萜类化合物(图A)。该研究发现,HEP14及其类似物通过不依赖于mTOR的方式选择性地激活转录因子TFEB,促进溶酶体生成。进一步研究发现,该类化合物直接激活蛋白激酶C(PKC)家族的成员PKCa和PKCd,导致蛋白激酶GSK3b的磷酸化,使之失活。该研究表明,GSK3b可以直接磷酸化TFEB的134位和138位的丝氨酸,使TFEB处于非活化状态,抑制溶酶体的生成。因此,PKC激活引发的GSK3b失活可以诱导TFEB入核而激活,从而促进溶酶体的发生。另一方面,该研究还发现PKCd的激活可以使溶酶体相关基因的抑制因子ZKSCAN3从细胞核中移位到细胞质中而失活,从而解除其对溶酶体生成的抑制(图B)。这一作用主要源于PKCd激活导致的蛋白激酶JNK和p38的激活,它们可以使ZKSCAN3的153位苏氨酸发生磷酸化,引发ZKSCAN3的核-质移位。因此,PKC作为一个主控开关,控制两条平行的信号通路,分别激活溶酶体相关基因的转录因子TFEB和失活转录抑制因子ZKSCAN3,从而促进溶酶体的发生(图C)。
由于许多细胞外信号(如生长因子、激素、趋化因子、神经递质、病原侵染等)可以与细胞膜上的受体(如RTK?GPCR和TLR等)结合,产生第二信使二酰甘油(DAG)而激活PKC。因此PKC介导的溶酶体生成是细胞在响应外界信号时产生溶酶体适应(lysosomal adaptation)的一种重要调控机制。
该研究还发现,在细胞模型中,激活PKC的二萜类化合物HEP14通过依赖于溶酶体的方式促进脂滴和变性蛋白聚集体的清除。在阿尔茨海默疾病的APP/PS1小鼠模型中,腹腔注射HEP14可显著减少小鼠脑部淀粉样蛋白沉积斑块的累积。研究表明这一效应依赖于PKC的激活。这些结果提示PKC的激活剂可能成为治疗溶酶体贮积病及神经退行性疾病的潜在药物。
杨崇林研究员和郝小江研究员为该论文的共同通讯作者。杨崇林研究组的博士后李洋博士和博士研究生徐猛为该论文的共同第一作者;蹇友理老师、刘学钊博士和刘锴博士参与细胞和生化实验;郝小江研究组成员丁骁、晏晨、邸迎彤、唐贵华、穆淑珍等参与了干预溶酶体生成的活性测试、化合物样品的制备、光亲和标记物的合成;中科院遗传与发育生物学研究所郭伟翔研究员、汪迎春研究员、黄夏禾老师和汤长勇同学在小鼠分析和蛋白质质谱分析方面提供了重要帮助;中科院生物物理研究所苗龙研究员、陈联万老师和中科院遗传与发育生物学研究所杨崇林研究组的王鑫老师在免疫电镜分析方面提供了重要帮助;中科院遗传与发育生物学研究所李婷老师在流式细胞术分析方面提供了重要帮助;HEP14等样品最早由贵州省-中科院天然产物化学重点实验室郝小江研究组的宋智琴等提供。该研究受到国家自然科学基金委重点项目、科技部以及中科院项目资助。
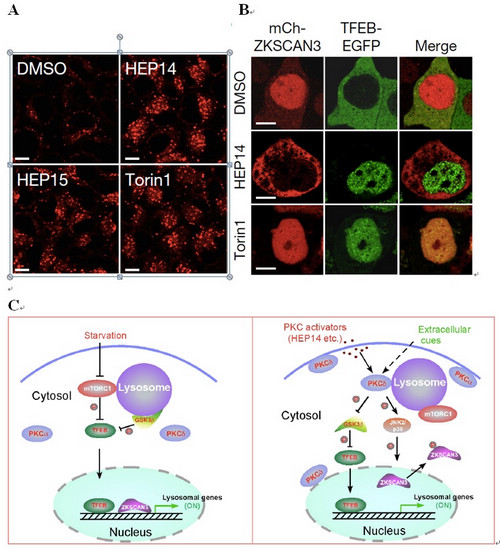
(A) HEP14和HEP15促进溶酶体的生成。(B) HEP14诱导TFEB-EGFP从细胞质向细胞核转移,同时mCherry-ZKSCAN3从细胞核向细胞质转移。
(C) 饥饿诱导的溶酶体发生机制(左)和PKC介导的溶酶体发生机制(右)的比较。