高彩霞研究组与李家洋研究组合作在作物基因组编辑育种技术方法研究中取得新进展
发布时间:2020.01.14
遗传与变异是物种进化的基础。通过物理、化学方法(如辐射诱变、EMS诱变)产生全基因组的随机突变已经成为农作物育种的常规手段,但其中具有新型农艺性状突变体的筛选较为费时、费力。定向进化(Directed Evolution)则通过创制目标基因的突变文库,在施加一定选择压力下能够快速获得目的突变体。目前,植物基因的定向进化通常先通过易错PCR、DNA合成或DNA重组等方法在体外产生目标基因的突变文库,再转化到大肠杆菌或酵母中进行功能筛选。然而,由于离开原始的基因组和细胞环境,筛选出来的基因突变可能并不能完全反映出它在植物中的真实功能。更重要的是,大多数重要农艺性状无法在大肠杆菌或酵母中进行筛选。因此,建立一种在植物原位进行基因饱和突变和功能筛选的定向进化新方法将有助于加快植物育种及重要功能基因研究的进程。近日,中国科学院遗传与发育生物学研究所高彩霞研究组和李家洋研究组合作,构建了新型的饱和靶向内源基因突变碱基编辑器STEME,并在植物中实现了基因的定向进化和功能筛选。
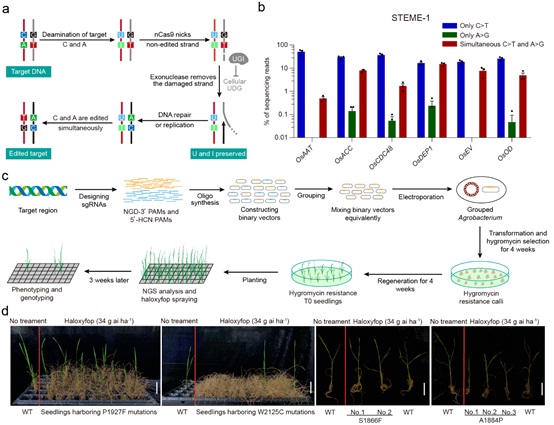
研究者将胞嘧啶脱氨酶APOBEC3A和腺嘌呤脱氨酶ecTadA-ecTadA7.10同时融合在nCas9 (D10A)的N端,并将抑制体内尿嘧啶糖基化酶UDG的活性的UGI以融合或自由表达的形式置于nCas9 (D10A)的C端,共构建了4种形式的双碱基编辑器STEME (STEME-1至STEME-4)。STEME双碱基编辑器均可以只在一个sgRNA引导下就可以诱导靶位点C>T和A>G的同时突变,显著增加了靶基因碱基突变的饱和度及产生突变类型的多样性。STEME-1在水稻原生质体中C>T诱导效率高达61.61%,C>T和A>G同时突变的效率也高达15.50%。为了提高靶基因的碱基覆盖度,研究者进一步利用能够识别NG PAM的变体Cas9-NG构建了第5个双碱基编辑器STEME-NG,发现只需要20个sgRNA就可以对OsACC上编码56个氨基酸的序列实现近饱和的突变。
为了展示STEME在植物中的定向进化能力,研究者设计了靶向OsACC羧基转移酶结构域上400个氨基酸编码序列的200个独立的sgRNA,分别构建到STEME-1或STEME-NG双元载体上。将构建好的双元载体分为27个转化组,每个组内混合了等分子量的4至11个sgRNA载体,覆盖80-142 bp的靶DNA区域,便于提高转化效率和突变的高通量测序。经农杆菌介导法转化水稻愈伤,共获得约6000株水稻再生苗。水培法炼苗10天后,对再生苗喷洒高效氟吡甲禾灵(Haloxyfop)进行筛选,共发现四个除草剂抗性突变位点:P1927F、W2125C、S1866F和A1884P。除W2125C以外,其余三个抗性位点未曾在植物中有过报道。其中,P1927F与W2125C突变一样表现出强除草剂抗性,具有较高的生产应用潜能。基于同源蛋白结构模型分析发现,这些氨基酸突变直接或间接地影响了除草剂结合口袋的构象,从而降低了其对除草剂分子的结合能力而获得除草剂抗性。
STEME技术体系的建立,对于原位(In situ)定向进化植物的内源功能基因提供了新型技术支撑,对农作物分子设计育种具有重要意义。此外,STEME系统还有望应用于不同细胞系、酵母或动物中的非编码区的顺式作用元件的调控、动物致病SNV的修正和抗药位点的筛选等。该研究成果于2020年01月13日在线发表于Nature Biotechnology杂志(DOI:10.1038/s41587-019-0393-7)。高彩霞研究组博士生李超、助理研究员张瑞以及李家洋研究组副研究员孟祥兵为本文共同第一作者,高彩霞研究员和李家洋研究员为共同通讯作者。遗传发育所陈宇航研究组和微生物研究所邱金龙研究组参与了部分研究工作。该研究得到中国科学院战略性先导专项、国家自然基金委等项目的经费资助。
 |
|
图:(a) STEME介导的双碱基(C>T和A>G)编辑策略。(b) STEME-1介导的碱基编辑产物类型分布。(c)利用STEME系统饱和突变OsACC CT结构域流程图。(d) STEME系统介导的OsACC氨基酸替换产生除草剂抗性。 |