戴建武研究组阐明脊髓发育早期微环境对神经再生的作用
发布时间:2024.04.03
“橘生淮南为橘,橘生淮北为枳”。这句古语道出了环境对个体生长发育的重要影响。同样,人体组织细胞也处在独特的微环境中,这个微环境由细胞外基质、各种细胞、可溶性的信号分子等共同组成。微环境在细胞信号传导、增殖和分化、形态和迁移、免疫应答以及营养代谢等方面发挥重要作用。深入研究细胞微环境对于了解生命奥秘和疾病治疗都具有重要意义。
脊髓损伤对于成年哺乳动物来说是一种毁灭性打击,由于成体脊髓组织存在多种抑制再生因素,并且神经细胞再生能力弱,最终导致损伤后脊髓功能的丧失。与成体组织不同,胚胎期和新生期脊髓组织在损伤后表现出强大的再生能力。深入解析脊髓不同发育时期的组织微环境差异,将为阐明脊髓再生机制奠定基础。
近日,中国科学院遗传与发育生物学研究所戴建武研究员团队在Cell Stem Cell 杂志在线发表了题为“Harnessing developmental dynamics of spinal cord extracellular matrix improves regenerative potential of spinal cord organoids”的研究论文。该研究工作利用多组学技术描绘了脊髓细胞外基质(ECM)随发育进程的动态变化,并阐明了发育早期的脊髓ECM蛋白在调控脊髓神经干细胞和脊髓类器官中的重要作用。
团队通过蛋白组和单细胞转录组分析了脊髓发育时期ECM的动态变化,发现与成体脊髓相比,发育早期脊髓含有ECM更为丰富,包含多种与神经发育和轴突生长相关的ECM蛋白,以及较少的神经再生抑制性ECM蛋白。为了阐明不同发育时期的外基质功能,研究团队制备新生兔的脱细胞脊髓ECM (Decellularized neonatal spinal cord ECM, DNSCM) 和成年兔的脱细胞脊髓ECM (Decellularized adult spinal cord ECM, DASCM) 。在物理特性方面,两种外基质均可以溶解后自组装形成水凝胶,在力学强度方面没有明显差别,但DNSCM表现出更快的成胶速率、更粗纤维直径、更高溶胀率,这提示不同发育时期脊髓ECM在物理特性方面存在差异。相比于DASCM,DNSCM可以促进脊髓神经前体细胞增殖、迁移和向神经元分化,以及促进神经元轴突生长和突触形成。此外,研究团体将脱细胞脊髓ECM应用于脊髓运动神经元类器官(Spinal cord motor neuron organoids, scMN-Organs)的构建。相比于类器官构建常使用的Matrigel,脊髓外基质具有更好的促进scMN-Organs轴突再生效果,体现了组织特异性外基质分子对类器官构建的独特作用。相比于DASCM,DNSCM进一步促进了scMN-Organs的轴突延伸和功能成熟。并且在体外损伤模型和多种共培养模型中,DNSCM显著增强了scMN-Organs在损伤后和抑制性环境下轴突的再生,以及scMN-Organs向靶组织的神经投射能力。为了进一步阐明外基质中调控神经再生的关键分子,团队通过对蛋白组学数据的分析,找到了DNSCM中高表达的候选蛋白,通过生物学实验证实腱糖蛋白 (Tenascin) 和多效蛋白 (Pleiotrophin) 对scMN-Organs轴突延伸发挥关键作用。
团队还发现DNSCM通过改善损伤后抑制性微环境促进内源性神经再生,并帮助外源神经干细胞向损伤区以外宿主组织中迁移和整合。DNSCM更有利于scMN-Organs在移植后的长期存活和成熟,增强了scMN-Organs和脊髓神经纤维之间的整合。
该研究工作从细胞外基质的角度阐释发育早期环境的重要作用,为促进组织再生提供了新思路。本研究第一作者为中国科学院遗传与发育生物学研究所博士生孙政。通讯作者为戴建武研究员和赵燕南青年研究员。该项目得到了国家自然基金委重点项目、科技部重点研发等项目资助。
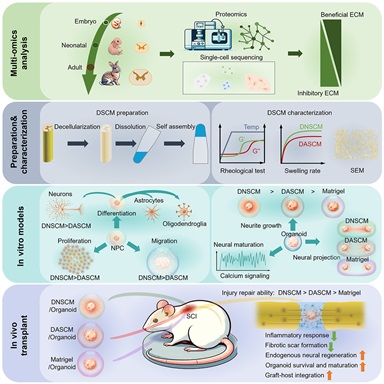
图:脊髓发育早期微环境促进神经再生研究总结